Cerebrale kreatinmangelsyndromer
Det er beskrevet tre sykdommer i kreatinomsetningen. Første pasient med kreatinmangel (GAMTdefekt) ble beskrevet i 1994. I 2001 ble ytterligere to sykdommer beskrevet (AGAT-defekt og transporterdefekt).
Kreatinomsetningen
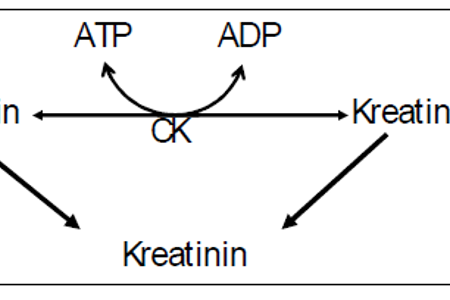
Figur 1, illustrasjon: OUS
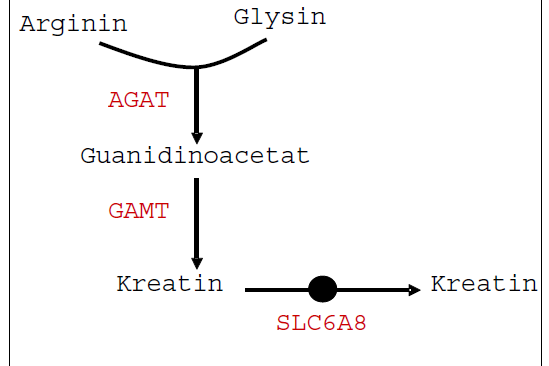
Figur 2, illustrasjon: OUS
Klinikk ved svikt i kreatinomsetningen
Behandling
Hovedprinsippet for behandling av AGAT- og GAMT-defektene er å erstatte manglende kreatin ved å gi kreatin per oralt. For GAMT-defekten er det i tillegg et poeng å redusere konsentrasjonen av GAA, fordi ikke bare mangel på kreatin, men også opphopning av GAA antas å være skadelig. Kreatintilskuddet bidrar faktisk også til redusert GAA-produksjon gjennom negativ feedback på AGAT. Videre kan AGAT-aktiviteten reduseres ytterligere ved å begrense inntaket av forstadiet arginin samtved å gi tilskudd av ornitin (kompetitiv enzymhemming).
Transporterdefekten er vanskeligst å behandle. Kreatintilskudd samt tilskudd av forstadiene arginin og glysin for respektivt å utnytte transportproteinets eventuelle restaktivitet og å øke intracellulær syntese av kreatin i nervevevet, har bare vist å ha noe effekt hos ca 1/3 av pasientene. Det forskes i dag på å finne kreatinderivater, for eksempel cyclokreatin eller ulike konjungater med aminosyrer eller lipider som kan transporteres over cellemembraner uavhengig av SCL6A8. Slike medikamenter må kunne tas peroralt, ikke brytes ned i mage-tarmtraktus, men bli absorbert og intracellulært være substrat for CK.
Arvegang og hyppighet
AGAT-defekten og GAMT-defekten er sjeldne, autosomalt recessive sykdommer. SLC6A8-mangelen arves X-bundet og synes å være hyppigere enn de to andre. Den rammer mest menn, men kvinnelige bærere kan imidlertid også få lette symptomer (på grunn av skjev X-inaktivering). Det finnes studier som anslår at SLC6A8-mangel finnes hos ca. 2 % av pasienter med X-bundet mental retardasjon.
Biokjemisk diagnostikk
Man kunne kanskje tenke seg at kreatinmangel kunne påvises indirekte ved å påvise lav konsentrasjon av endeproduktet kreatinin i urin eller plasma, men så enkelt er det dessverre ikke. Mange av pasientene har upåfallende konsentrasjoner av kreatinin. Derimot vil måling av kreatin og GAA kunne fange opp alle tre. Første november 2006 ble slike målinger en del av metabolsk screening ved vår seksjon. Analysene gjøres ved hjelp av LC-MS-MS. Den diagnostiske strategien begynner med vurdering av kliniske opplysninger på rekvisisjonen. Hovedregelen pasienter med mental retardasjon får utført analyse av kreatin og GAA i urin. Pasienten skal helst ikke spise kjøtt eller fisk dagen før urinprøven (morgenurin) tas. Analysen i plasma gjøres kun hos pasienter med avvikende funn i urin (se tabell 1).
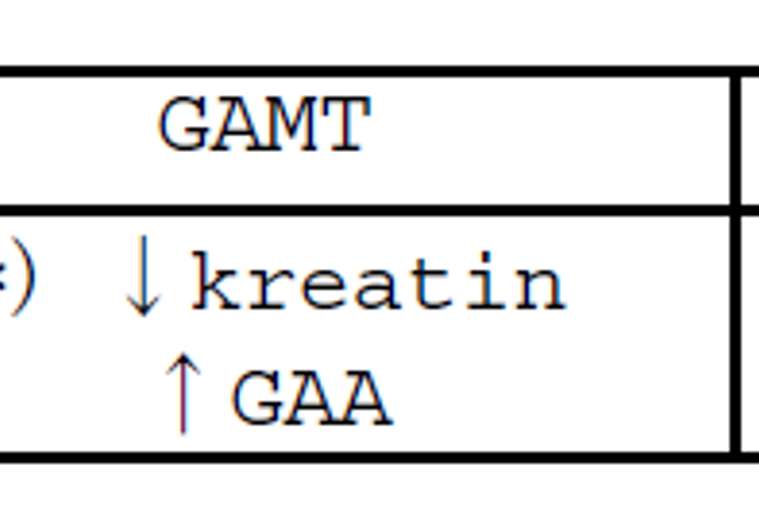
Tabell 1
Tabell 1
AGAT- og GAMT-defekt gir begge lav kreatin, og har henholdsvis redusert eller økt mengde GAA. AGAT-mangel er den vanskeligste diagnosen å stille biokjemisk. Kvinnelige bærere av transporterdefekt vil være vanskelige å fange opp, ettersom de ofte ikke har den typiske biokjemiske fenotypen som menn har.
Det finnes feilkilder til avvikende kreatin- og kreatininverdier. Dersom ikke urinprøven fryses umiddelbart vil likevekten mellom kreatinin og kreatin kunne forskyves in vitro. Lave kreatininverdier sees hos pasienter med liten muskelmasse. Høye verdier av kreatin sees også ved høyt kreatininntak, muskeldystrofier og thyreotoxicose. Det er også viktig å unngå inntak av kjøtt og fisk dagen før prøvesamling.
Magnetisk resonans spektroskopi
Cerebral kreatinmangel kan påvises direkte ved alle tre tilstandene med magnetisk resonans spektroskopi (MRS). MRS vil være en naturlig oppfølgende undersøkelse, for å bekrefte positive biokjemiske funn og for å utrede videre tilfeller med lette biokjemiske avvik, men karakteristisk klinikk. Heller ikke MR-spektroskopi trenger imidlertid å vise avvik hos kvinner med mutasjon i SLC6A8.
Genetisk analyse
Mutasjonsanalyse for AGAT og GAMT utføres ved ved utenlandske laboratorier. Mutasjonsanalyse for SLC6A8, som også er gullstandard for diagnose hos kvinner. utføres ved Avdeling for medisinsk genetikk, OUS. Endelig bekreftende diagnostikk med proteinanalyser vil måtte foregå i utlandet.
Oppsummering
Kreatinmangelsykdommer er viktige behandlbare årsaker til mental retardasjon, selv om det ennå ikke finnes fullgod behandling for den hyppigste, defekt av kreatintransporteren (SLC6A8).