Diagnostikk av medfødte stoffskiftesykdommer
Det er en rekke kliniske situasjoner som kan gi mistanke om medfødte stoffskiftesykdommer, se henvisningskriteriene. Vanlige laboratorieprøver som glukose, syre/base-status, laktat og ammoniakk, billeddiagnostikk og elektrofysiologiske undersøkelser er også viktige i utredningen.
Ofte vil diagnostikken i tillegg kreve undersøkelse av spesielle metabolitter som vårt laboratorium har landsfunksjon for. Sensitiviteten av biokjemisk screening for ulike medfødte stoffskiftesykdommer varierer. Noen ganger sees vedvarende, patologiske avvik som gir mistanke om en spesifikk sykdom eller peker mot en sykdomsgruppe. Andre ganger kan medfødt stoffskiftesykdom være vanskelig å påvise eller utelukke. Dette kan skyldes preanalytiske feil, men funnene kan også påvirkes av pasientens kliniske tilstand når prøven tas. For eksempel kan analysen av organiske syrer ved en fettsyreoksidasjonsdefekt kun vise avvik når pasienten er i en katabol situasjon, mens acylkarnitinprofilen i plasma oftere vil vise avvik også i en stabil klinisk tilstand. For noen sykdommer har analysene redusert sensitivitet, ved at vi ennå ikke har gode nok biomarkører. Noen analyser må sendes til utlandet, fordi de ikke utføres i Norge. Vi vil opplyse om aktuelle laboratorier i våre svarrapporter eller ved forespørsel.
De siste årene har det vært en rivende utvikling i genteknologiske analyser, og eksom- og genomsekvensering har blitt viktige også i diagnostikk av medfødte stoffskiftesykdommer, ofte i form av paneler med et varierende antall gener som er relevante for en problemstilling. Avdeling for medisinsk genetikk (AMG) ved Oslo Universitetssykehus har etablert flere paneler for metabolske sykdommer, både et generelt metabolsk panel, panel for mitokondriesykdommer og for CDG-syndromer, se genetikkportalen.no.
Det er imidlertid ikke slik at genpaneler alltid er best og skal brukes primært. Grunnen til det er at man ved de brede genpanelene får opp svært mange varianter i ulike gener som mulige årsaker og det kan være svært arbeidskrevende og ofte ikke mulig å avklare hvilke(n) variant(er) som kan være sykdomsfremkallende; se også generell informasjon om NGS genpanel i genetikkportalen. Som hovedregel skal biokjemisk utredning gjøres først, men i akutte situasjoner eventuelt parallelt med genanalyser. Leger ved AMG og våre leger kan så i fellesskap vurdere resultatene av de ulike analysene samlet. Basert på biokjemiske analyser kan man ofte velge ut gener som er mest aktuelle for en pasient. I noen tilfelle er det snakk om få gener, andre ganger flere, f.eks. ved metylmalonsyreemier. Ved mitokondriesykdommer kan det være snakk om over hundre gener. Noen ganger vil også resultatene fra et genpanel peke mot en metabolsk sykdom som pasienten ikke er undersøkt biokjemisk for, og biokjemisk utredning vil da utføres etter genetisk undersøkelse. Genetisk og biokjemisk utredning supplerer med andre ord hverandre, og dette er spesielt viktig ved usikre funn. I slike situasjoner kan det fremdeles være aktuelt også å måle enzymaktivitet eller gjøre funksjonelle studier i celler for å avklare betydningen av funn som er gjort.
Medfødte stoffskiftesykdommer bør derfor utredes ved å sammenstille klinikk, biokjemiske data, genetiske data og ev. data fra studier av enzym/protein, se figur.
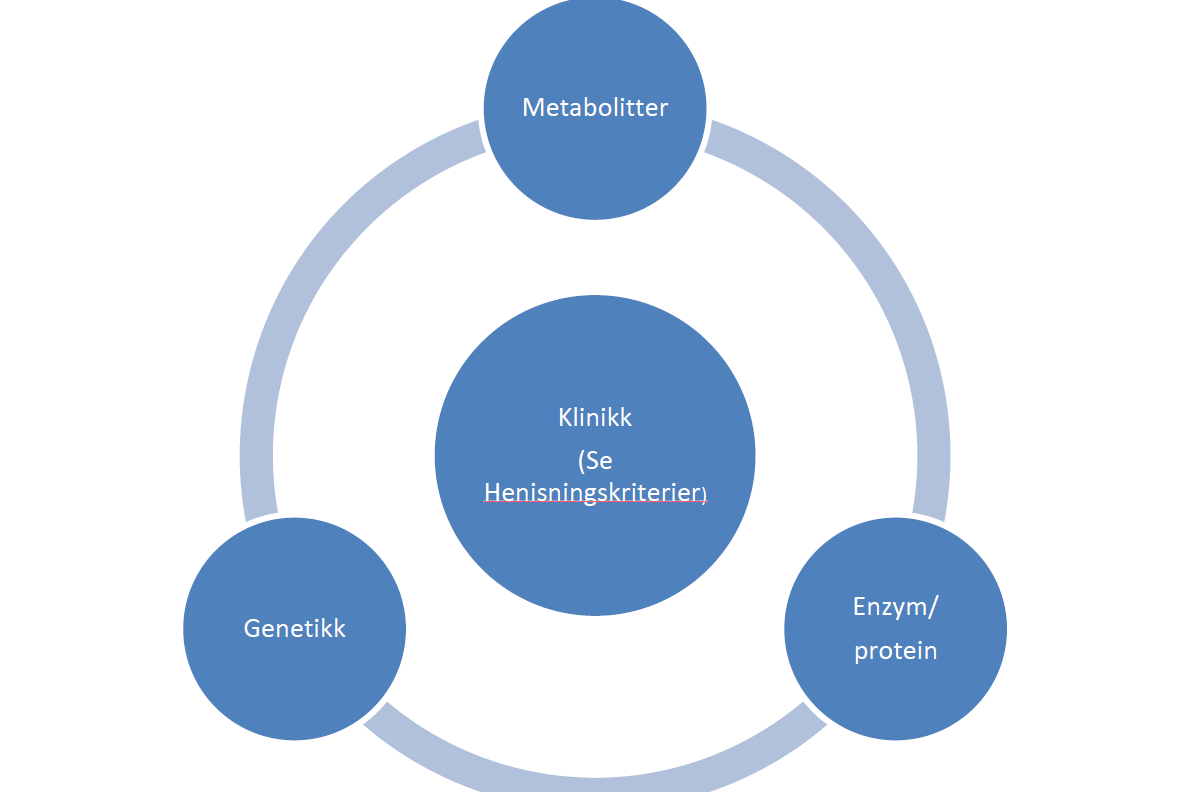
Illustrasjon: Yngve Thomas Bliksrud