Antistoff med lang hals beskytter mot virusinfeksjon
Ny forskningsstudie har avslørt hvordan antistoffet IgG3 kan aktivere immunsystemet effektivt på innsiden av våre celler, og beskytte mot virusangrep.

Ny publisering: Forsker Stian Foss sammen med Alexandra Jonsson, som i samarbeid med gruppen til Leo James har avslørt den nye siden ved antistoffet IgG3. Studien ble nylig publisert i prestisjetidsskriftet Science Immunology. Foto: Simone Mester.
Skrevet av: Stian Foss Forsker ved Avdeling for farmakologi, Universitetet i Oslo og Jan Terje Andersen forskningsgruppeleder ved Avdeling for immunologi og transfusjonsmedisin, Oslo universitetssykehus. Professor i biomedisinsk innovasjon ved Avdeling for farmakologi, Universitetet i Oslo.
Funnene baner vei for design av antistoffer som er skreddersydd for å bekjempe infeksjonssykdommer, men også for helt andre indikasjoner. Resultatene ble nylig publisert i tidsskriftet Science Immunology.
Konstant angrep av virus
Vi er under konstant angrep av virus. Immunsystemet trer raskt i kraft og setter inntrengerne sjakkmatt. Men noen virus kan få overtaket og gi alvorlig sykdom, som kreft eller til og med føre til død. Heldigvis, nedkjemper kroppen de aller fleste infeksjoner etter kort tids sykdom.
Virus må komme seg inn i cellene våre. Det gjør de ved å binde seg til målmolekyler. Målmolekyler er proteiner som vises frem på cellenes overflate. De er selve inngangsdøren for virus. Når de har entret, utnytter virusene cellens maskineri for å lage mange kopier av seg selv. De kan da spre seg og gjenta prosessen.
Når vi gjennomgår en virusinfeksjon, eller blir vaksinert, produserer kroppen antistoffer som er rettet mot det aktuelle viruset. Målet er at det produseres antistoffer i rikelige mengder samtidig som de har en kvalitet som gjør at de binder seg effektivt til viruset og blokkerer adgang til inngangsdøren.
Merkelapper og det cytosoliske rom
I blodet har vi store mengder antistoff til enhver tid. De patruljerer og overvåker kroppen for så å slå til når noe er på ferde. Patruljen domineres av en blanding av fire forskjellige antistoffklasser. Det er mest av IgG1 mens det er mindre av de IgG2, IgG3 og IgG4. De er like i arkitektur med en karakteristisk Y-form med to armer (Fab-armer) som kan binde seg til viruset. Armene er koblet til en hals fulgt av en konstant del (Fc) som kan rekruttere immunceller ved å binde antistoff-reseptorer på cellenes overflate. Det kan føre til at cellene spiser viruset og bryter det ned.
Antistoffer som er bundet til virus kan også rekruttere en del av immunsystemet som heter komplement. Det består av en rekke proteiner som aktiverer hverandre som dominobrikker. Disse «merkelappene» gjør at viruset gjenkjennes og ødelegges før det gjør skade.

I samarbeid med forskningsgruppen til Leo James ved MRC Laboratory of Molecular Biology (Cambridge, UK) har vi tidligere avslørt en helt ny måte komplementsystemet kan begrense virusinfeksjon på. Det skjer ved at komplementproteinet C4 binder seg til antistoff-bundet virus og blokkerer inngang til cellenes indre, det cytosoliske rom. Resultatet er at C4-bundet virus ender opp i cellenes søppeldynge, lysosymene, hvor det brytes ned.
Videre har vi vist sammen med forskningsgruppen til James at selv når virus med antistoff bundet til sin overflate klarer å komme seg helt til cellens indre, det cytosoliske rom, så kan antistoffene rekruttere et protein som heter TRIM21. Det setter i gang en rask prosess hvor nedbrytningsapparatet til cellen går til angrep på viruset, og fjerner det.
IgG3 er flinkest i klassen
I den nye studien vår viser vi at humant IgG3 er overlegent når det kommer til å sette virus ut av spill, både via komplementproteinet C4 og TRIM21. Begge mekanismene er mer effektive for IgG3 enn for de andre klassene; IgG1, IgG2 og IgG4.
Vi viser videre at dette skyldes at IgG3 har en usedvanlig langstrakt hals som til stor fordel er mer fleksibel enn for de andre klassene, og gjør at mekanismene lett lar seg fyre av på en svært effektiv måte. Dette kan være med å forklare hvorfor vi har lite IgG3 i kroppen til enhver tid. Det er rett og slett et veldig potent antistoff, hvor dets produksjon må nøye reguleres for ikke å få overtenning.
Ved en grundig og systematisk kartlegging har vi avslørt hvilke deler av den lange halsen som er avgjørende for at IgG3 kan fjerne virus effektivt. Vi viser også hvordan vi kan designe antistoffer med finjustert evne til å engasjere C4 og TRIM21, samt hvordan vi kan skreddersy IgG3 slik at det blir mer potent enn hva naturen selv har evolvert frem.
En slik grunnleggende kartlegging av sammenhengen mellom antistoffers struktur og funksjon utvider vår forståelse av hvordan immunsystemet er i stand til å bekjempe virusinfeksjon, og ikke minst hva som skal til når vi utvikler for eksempel mer effektive vaksiner.
Videre er slik dyptpløyende kunnskap avgjørende når vi skal snekre sammen «superantistoffer", som kan bli viktige terapeutiske og profylaktiske verktøy rettet mot nye virus og fremtidige pandemier. Men også for antistoffer skreddersydd for andre indikasjoner enn nettopp infeksjonssykdommer, som kreft.
Den dyptpløyende studien er et resultat av et pågående samarbeid med laboratoriet til James ved MRC Cambridge, hvor utvekling av kunnskap og studenter mellom våre laboratorier er nøkkelen til suksess. Som del av den nye studien var daværende master-student Alexandra Jonsson på utvekling i Cambridge hvor hun gjennomførte avklarende forsøk. Forsker Stian foss har vært lab-veileder for Alexandra, og de deler førsteforfatteskapet på den nye studien publisert i Science Immunology.
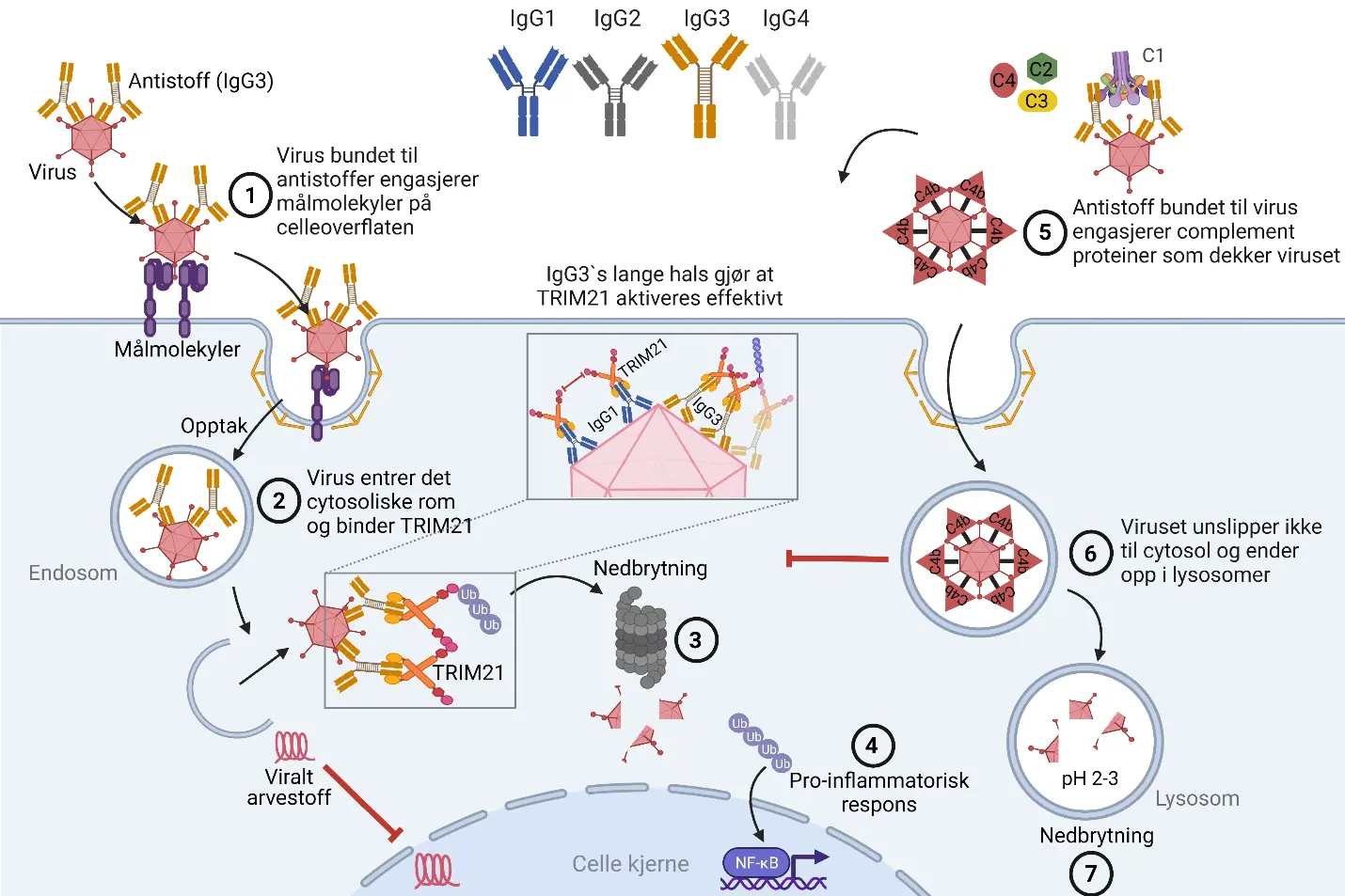
Effektiv fjerning av virus via IgG3-aktivert intracellulær immunitet: Illustrasjonen viser (1) ett virus som binder målmolekyler på celleoverflaten når det har antistoffet IgG3 bundet til sin overflate. IgG3-bundet virus går deretter inn i cellens endosomer og videre til (2) det cytosoliske rom hvor TRIM21 binder seg til IgG3. Den lange halsen til IgG3 gjør at TRIM21 aktiveres mer effektivt enn de andre IgG-variantene vi har (IgG1, IgG2 og IgG4). (3) Dette leder til rask nedbrytning av viruset samt (4) produksjon av pro-inflammatorisk signalmolekyler som informerer nærmiljøet om at cellen er blitt angrepet av virus. (5) IgG3 bundet til virus kan også rekruttere komplementproteiner som fester seg til virusets overflate. Dette gjør at viruset blir arrestert i endosomene og ikke når det cytosoliske rom, men isteden (6) ender opp cellens søppeldynge, lysosomene, hvor det bli brutt ned (7). Figuren er laget av Stian Foss ved hjelp av BioRender.
Les tidligere blogginnlegg:
Publikasjon:
“Potent TRIM21 and complement dependent intracellular anti-viral immunity requires the IgG3 hinge,” Stian Foss, Alexandra Jonsson, Maria Bottermann , Ruth Watkinson , Heidrun E. Lode, Martin B. McAdam, Terje E. Michaelsen, Inger Sandlie, Leo C. James, Jan Terje Andersen.
Science Immunology, doi: 10.1126/sciimmunol.abj1640
Følge forskningsgruppen i sosiale medier:
Hjemmeside: https://www.ous-research.no/andersen/
Facebook: https://www.facebook.com/AndersenLaboratory/
Twitter: @AndersenJT