Paradigmeskifte for behandling av tykktarmskreft etter kirurgi
Bruk av kunstig intelligens kan vise seg å bli en viktig brikke i veiledningen av tilleggsbehandling for pasienter med tykktarmskreft. I dag finnes det systemer for slik veiledning, men de er ikke presise nok til å velge ut hvilke pasienter som vil ha nytte av behandlingen. Det fører til at mange pasienter får behandlingen uten å trenge den.
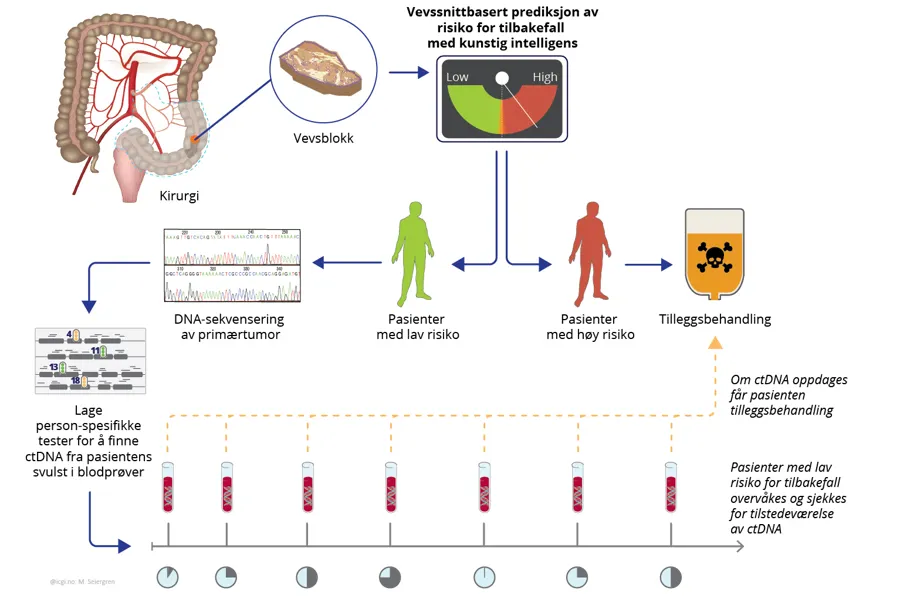
I tidsskriftet Nature Reviews Clinical Oncology skisserer professor David Kerr fra Universitetet i Oxford, sammen med kolleger fra Institutt for kreftgenetikk og informatikk ved Oslo universitetssykehus, et nytt paradigme for persontilpasset tilleggsbehandling for pasienter med tykktarmskreft. Ved å kombinere kunstig intelligens-genererte digitale patologiverktøy, standardisert vurdering av vevssnitt og sirkulerende tumor DNA (ctDNA)-analyse av blodprøver tatt regelmessig i månedene og årene etter operasjon, kan flere enn halvparten av pasientene med tykktarmskreft i stadium II og III, som i dag får tilleggsbehandling på grunn av moderat risiko for tilbakefall, skånes fra tilleggsbehandling fordi det er svært lite sannsynlig at de vil ha nytte av den.
Det anslås at av de pasientene som er operert for tykktarmskreft i stadium II og III, så får 30 % av disse tilbakefall uten tilleggsbehandling. Valget av tilleggsbehandling for disse pasientene baseres på konvensjonelle kliniske og patologiske vurderinger som ikke er presise nok til å angi risikoen for tilbakefall og derfor fører til at mange overbehandles for å kunne tilby tilleggsbehandlingen til mindretallet som trenger den.
- «Jo bedre vi forstår sannsynligheten for tilbakefall, jo bedre kan vi skreddersy tilleggsbehandlingen, og dermed for alvor tilrettelegge for persontilpasset behandling», sier David Kerr, som er professor ved Universitetet i Oxford, tidligere president i European Society for Medical Oncology (ESMO) og spesialist i behandling av tykktarmskreft.
ctDNA har vist seg å ha klinisk nytte for tidlig påvisning av potensielt tilbakefall hos pasienter med tykktarmskreft. Analysen er imidlertid kostbar og må gjentas jevnlig fordi tilbakefall langt frem i tid vanligvis ikke vil kunne oppdages med denne analysen. Den første vurderingen av en pasients ctDNA status skjer sjelden før fire uker etter kurativ kirurgi og i tillegg ikke før to uker etter avsluttet tilleggsbehandling (denne forsinkelsen skyldes vedvarende forhøyede nivåer av kreftcellefritt DNA flere uker etter behandling). Gitt de usikre konsekvensene en utsettelse av oppstart av tilleggsbehandling kan medføre, og det faktum at noen pasienter ikke har påvisbart ctDNA ved første oppfølgingsvurdering, foreslår professor Kerr og kollegene å bruke vevsbaserte biomarkører for å tilrettelegge for et tidlig forhåndsvalg av behandling som gjør at tilleggsbehandlingen ikke utsettes for de mest alvorlige krefttilfellene.
Forbedre pasientbehandlingen
Dagens biomarkører er ikke optimale når det gjelder å skille på nytteverdien av tilleggsbehandling for pasienter med tidlig stadium av tykktarmskreft.
I 2020 viste Skrede et al. hvordan kunstig intelligens (KI) kan brukes til å forutsi utfallet til pasienter med tykktarmskreft i en studie i The Lancet (Skrede et al., The Lancet 2020). KI-markøren, kalt DoMore-v1-CRC, predikerer sannsynligheten for kreftspesifikk død ut fra digitaliserte vevssnitt. Basert på funnene har markøren blitt integrert med andre etablerte biomarkører og tilrettelagt i et klinisk beslutningsstøttesystem, hvor klinikere kan veiledes i valg av tilleggsbehandling for pasienter med tykktarmskreft i stadie II og III, der hele svulsten ble fjernet ved kirurgi (Kleppe et al., Lancet Oncology 2022).
Ettersom beslutningsstøttesystemet kan definere en anbefaling kort tid etter kirurgi, kan pasienter som identifiseres med høy risiko for tilbakefall, påbegynne tilleggsbehandlingen på et tidligere tidspunkt enn dersom en skulle ventet på funn av ctDNA. Beslutningsstøttesystemet vil også kunne identifisere flere pasienter som kan ha nytte av kjemoterapi blant de som er ctDNA-negative ved første vurdering. Pasienter som blir klassifisert som lav risiko med behandlingsstøttesystemet vil primært kun overvåkes, og vil få tilleggsbehandling først ved eventuell ctDNA-deteksjon om det skulle oppstå.
- "Jeg tror at integrering av prognostiske biomarkører i vev og blod, som vi foreslår i denne artikkelen, er fornuftig med tanke på en mer persontilpasset behandling for kreftpasienter med tykktarmskreft", sier professor Kerr.
En slik løsning vil også kunne bidra til å redusere kostnader, både for personell og utstyr, i tillegg til å forbedre pasientbehandlingen – som til syvende og sist er målet!